原子量 と 分子量 の 違い
あなた を 好き な 異性 占い 無料分子量って何?原子量・分子量・式量の違いを徹底解説! │ . 原子量・分子量・式量の違いを徹底解説! 原子量の"親戚"にあたる分子量。 分子量の計算は、高校化学では当たり前のように必要になります。 ワニ塾長 考え方は原子量とほとんど一緒! この記事で、基本や計算方法を身に付けよう! ※原子量について詳しく勉強したい人は こちら ! 目次 1. 分子量とは? 1.1. 分子量は、分子を構成する原子の原子量の総和 1.2. 分子量にも単位はない 1.3. 例題 2. 分子量と式量 2.1. 分子式と組成式 2.2. 式量とは? 分子量との違いは? 2.3. イオンも"式量" 3. 分子量から物質量 (mol)の求め方 3.1. 分子量とmolの関係 3.2. 「原子量」と「分子量」の違いとは?分かりやすく解釈 | 違い . 「原子量」 と 「分子量」 の違いを大まかに説明すると、 「原子量」 は 「1つの原子の質量」 のことを意味します。 そして、 「分子量」 は 「複数の原子から構成される分子の質量」 のことを指します。. 原子量、分子量、式量、質量などの意味と違い - Ultrabem. 単位をもたない原子量、また原子量の和として定義されているために同様に無単位の分子量および式量に対して、質量 mass は 単位をもつ量 である。よく分子量の単位として誤使用される Da は 1924 年に提案され、2006 年に国際単位系. 原子量とは?求め方や単位も見やすい図と例で即理解!分子量 . よくある疑問として、「原子量と分子量の違いがわからない」というのがあります。 そんな疑問を解消しておきましょう。 分子量とは、原子量を足したものです。 例えば、H 2 Oの分子量を考えてみましょう。. 原子量と分子量・式量:物質量(mol)とアボガドロ数の関係 . 分子量の計算は簡単であり、原子量を足すだけです。 例えば、原子量が水素(H:1)、炭素(C:12)、窒素(N:14)、酸素(O:16)、塩素(Cl:35.5)のとき、分子量は以下のようになります。 O 2 =16×2=32 H 2 O=1×2+16=18 NH 3 =14+1×3=17 CO 2 =12+16×2=44 HCl=1+35.5=36.5. 原子量・分子量・式量 | ねこでもわかる化学. 分子(非金属+非金属の共有結合の物質)を構成している原子の原子量の総和を 分子量 と呼ぶ。単純に原子量を足せば良い。 NH 3 ならば、N=14、H=1.0なので、 NH 3 =14+1.0×3=17 式量 イオン(例:Na+など)を構成している原子. 【5分でわかる】原子量の定義と求め方、質量数との違いを徹底 . 分子量とは 分子式中の各原子の原子量の合計値のことです。 例:H(水素)の原子量 1 とO(酸素)の原子量 16 とすると、(テストでは必ず与えられるので覚える必要はありません。)H 2 O(水)の分子量は、1×2+16×1=18となり. #01 原子量・分子量・式量 → High Chemi. 転生 賢者 の 異 世界 ライフ rar
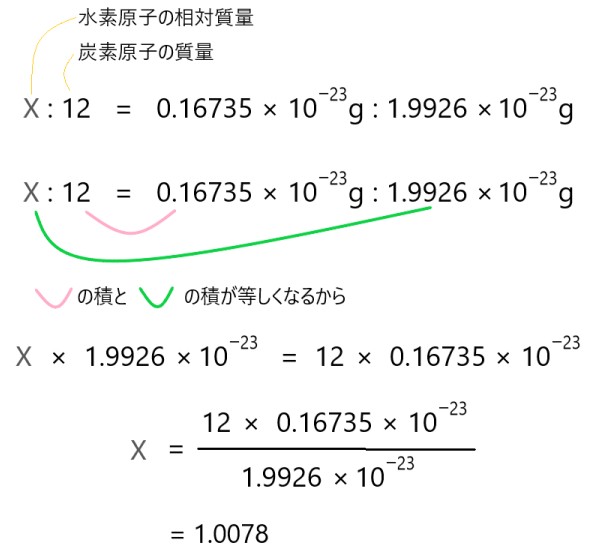
顎 が 外れ た 時 の 対処 法分子量・式量について 例題 演習問題 ①原子量 ②分子量・式量 原子量について 原子量とは 「質量数12の炭素原子1個の質量を12とし、これを基準とした他の原子1個の相対質量。 同位体がある場合は、各同位体の相対質量と存在比よりもとめた平均値。 と言われても、よくわからない… 相対質量とは まず相対質量って何? 「 相対質量 」とは、何かと比較した質量 ⇒ハローキティの体重は リンゴ3個分 「 絶対質量 」とは、他のものと比較していない質量 ⇒リンゴの平均的な質量は 約300g 質量数12の炭素原子1個の質量は1.99×10 −23 g で軽すぎる! このときの質量を12としよう! (⇒これを相対質量の基準とする) これなら数字が大きくて扱いやすい!. 原子量・分子量・式量と物質量(mol)、化学計算の基本 - 受験の月. よって, 分子量とは言わず, 式量という. 平均分子量も原子量と同様, 存在比を考慮した平均値である. {空気の平均分子量28.8は暗記}しよう. 着目する気体の分子量と28.8を比較すると, {空気より軽いか重いかがわかる}からである. 原子量・分子量・式量とは - 化学徒の備忘録(かがろく)|化学系 . 原子量や分子量、式量はモル質量とは異なります。. その違いについては以下のページに書いてあります。. 原子量とは 元素の原子量とは、各元素の原子の相対的な質量を炭素原子を基準に表した値である。. 炭素原子の同位体のうち、軽い質量数12の炭素12 . 物質量の基礎 | 高校化学のものがたり. 本記事では,原子量の意味や分子量と式量の違いを理解し,物質量の基礎的な内容を完全にマスターできます! 目次 原子量とは 絶対質量 相対質量 分子量とは 式量とは 物質量をマスターしよう! 原子量とは 原子量を理解する前に, 絶対質量 と 相対質量 について理解していきましょう! ここを疎かにしている人は多いですが,非常に大切なところです! 一緒に理解していきましょう! 絶対質量 絶対質量とは,原子1個の実際の質量のことです. 原子1個の質量は10 23 g程度という,非常に小さな値となります. このような小さな値を扱うことは非常に大変です. 実際に毎回10 23 と書くのはめんどくさいですよね. そのために作られたのが,以下で紹介する 相対質量 というものです. 相対質量. 【物質量 mol】原子量・分子量・式量の違いって何? - スマホ . 2020-09-22 【物質量 mol】原子量・分子量・式量の違いって何? 原子量・分子量・式量とは 原子量 分子量 式量 物質量molとは molってなに? 問題演習 1原子量を求める問題 2molの計算 3総合問題 問題演習の答え 今回の記事は高校になって初めて化学を勉強していてつまずく分野、第一位「mol」です! いきなり化学を勉強させられて原子や分子、分子量、物質量、相対質量など様々な単語が出てきてパニックになっている高校生、めちゃくちゃ多いと思います。 今回はそんな疑問を解決して、化学の完全攻略に一歩近づきましょう。 原子量・分子量・式量とは 私たちが生活する地球上において全てのものは多くの分子という粒が集まってできています。. 式量と分子量の違いをわかりやすく解説|受験化学の疑問を . 原子量というのは、その原子に存在する同位体の相対質量と その存在比率を考慮して計算するのでしたね。 単純な平均値を求める方法ではダメでした。 今回の記事では原子量の計算の仕方を前提として 式量と分子量の違いについて解説してみたいと思います。 スポンサードリンク 式量と分子量の違い 原子量は原子1個の重さを表す数値ですが、 分子1個とかイオン1個を表す数値だって表現することができます。 分子1個の重さを表す数値は分子を構成する原子の原子量の総和、 イオン1個の重さを表す数値はイオンを構成する原子の原子量の総和 という形で表現できます 。 特に難しいものではありません。 化学式を見た時に、そこにでてきた原子の原子量を全部プラスすると 分子量だったり、式量だったりが計算できるということです。. 相対質量・原子量・分子量・式量の定義、求め方、計算問題 . 塩素原子の原子量が35.5のとき、塩素原子の2つの同位体 35 Cl(相対質量=35.0), 37 Cl(相対質量=37.0)の存在比をそれぞれ求めよ。 こちらも同じように、「同位体の相対質量に、それぞれの存在比をかけて足すと、原子量を求めることができる」ことを利用して解く。. モル質量と原子量と分子量と式量の違いとは? | 化学受験 . しょうご じゃあ、原子量、分子量、式量は1molあたりの質量じゃないの? という疑問が聞こえてきそうですね。 原子量、分子量、式量とは? 原子量、分子量、式量は、12C=12にした相対質量を元に導き出されている数値です。 相対質量は12C=12を基準とします。 このように12個の水素と1個の炭素がつり合いますよね。 てことは、水素原子は炭素原子の1/12倍の質量です。 なので相対質量も12分の1ですよね。 だから、1Hの相対質量は1なんですよ。 12C原子と比べて何倍か? ってので相対質量を決めているので相対質量に単位はありません。 じゃあ、原子量は? 原子量は、相対質量の期待値なんですよ 。 というのも、原子には 同位体 があります。 同じ原子番号なのに、中性子数が異なる奴らですね。. "モル質量"と"原子量・分子量"の違い - 化学徒の備忘録(かがろく . 分子量は 相対質量 であるため、無次元量です。 つまり、単位はありません。 つまり、分子量の基準や考え方は原子量と同じです。 モル質量と原子量・分子量の違い モル質量は、ある物質1 molがもつ 質量 であり、単位も存在します。 それに対して、原子量や分子量は 質量の相対値 であり、単位のない無次元量となります。 整理すると、モル質量と原子量、分子量の違う点は 質量か質量の相対値か 単位がある値か単位の無い値か の2点といえます。 一般的にはモル質量の単位がg/molであるときは、その値は原子量、分子量と等しい値となるため、比較をするときはモル質量の単位がg/molであることに注意することが重要です。 « 赤外活性とラマン活性・交互禁制則と判断… タンパク質の一次構造の決定方法 ». 原子と分子の違いが読むだけでわかる! - 中学理科の苦手解決 . 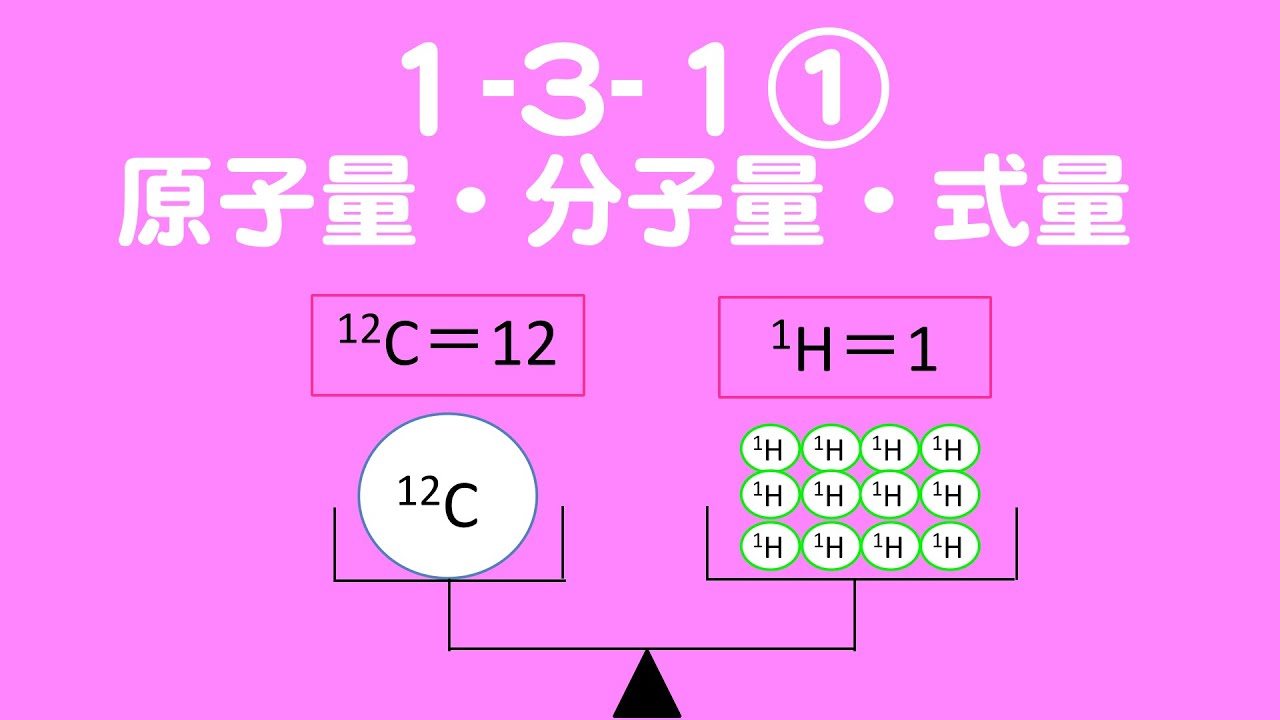
妊娠 中 おしり の 骨 が 痛い【図解版】原子・分子・元素の違いと原子の構造を解説(陽子 . 【図解】高校化学基礎より、原子の構造、分子との関係性、原子と元素の違い、陽子・中性子・電子・質量数・原子番号の関係性と違い、原子核とは何かなど、具体的に図を示しながら丁寧に解説します。. PDF 原子量・分子量・式量 巻出健太郎 - Nhk | 日本放送協会. 朝起き る と 蕁 麻疹
会津 出会い の 場1粒 の質量を求めるには100 粒もあれば十分だ。 その結果をまとめたのが右 の図である。 原子量・分子量・式量 ゴマと米と小豆の各1 粒の質量の関係は, 実際の質量ではどの程度,異なるのか比較しにくい。 そこで, 一番. 分子量とは?単位と簡単な計算方法も解説! - 受験のミカタ. 分子量は、化学の原子分野を勉強する上で非常に重要です。本記事では高校化学における分子量について、化学が苦手な人でも理解できるように早稲田大学に通う筆者が解説しています。分子量とは何か、分子量の求め方だけでなく、 分子量から物質量[mol]を求める計算方法 も紹介しています。. 原子量と分子量と式量の違い - 効率学習研究会. 分子量は分子式を構成する原子すべての 原子量の総和 と等しくなります。 分子も相対質量なので 単位はありません 。 例 二酸化炭素は分子式 CO2 です。 原子量は問題に与えられますが、炭素12、酸素16です。 (だいたい有効数字2桁で与えられます。 塩素は中途半端で35.5とされますが。 w) 二酸化炭素は分子式の通り、炭素が1個、酸素が2個の比で構成されているので、 二酸化炭素の分子量は 12+16×2=44 です。 原子量に原子の個数をかけて足せば良いだけですよ。 水は分子式 H2O です。 原子量は、水素1.0 酸素16です。 水は分子式の通り、水素が2個、酸素が1個の比で構成されているので、 水の分子量は 1.0×2+16=18 です。 もっとややこしい分子でも同じです。. 【高校化学基礎】「原子量とは」 | 映像授業のTry IT (トライイット). Try IT(トライイット)の原子量とはの映像授業ページです。Try IT(トライイット)は、実力派講師陣による永久0円の映像授業サービスです。更に、スマホを振る(トライイットする)ことにより「わからない」をなくすことが出来ます。全く新しい形の映像授業で日々の勉強の「わからない . 原子・分子の違いをわかりやすく解説!【中学 理科 . 原子・分子の違いをわかりやすく解説! 【中学 理科】|かめのこブログ 中学校で学習する「原子」と「分子」の違いはよく理解できていますか? この記事では、「原子・分子の違い」「原子で存在する物. 元素と分子の違いとは?違いを解説 | 違い辞典. その結果、周期表が作成され、元素の分類と理解が進展しました。. 一方、分子は、2つ以上の異なる元素または同じ元素の原子が結合してできた物質です。. 分子は、元素の単体よりも大きな単位であり、化学反応においてもっとも基本的な単位となります . 量子力学 - Wikipedia. 量子力学( りょうしりきがく 、 英: quantum mechanics )は、 一般相対性理論 と共に 現代物理学 の根幹を成す理論・分野である [1] [2] 。. 主として、 分子 や 原子 あるいはそれを構成する 電子 などを対象とし、その 微視的 な 物理現象 [3] を記述する 力学 で . お椀形状の単一分子から、異なる誘電応答性を示す結晶を作成 . 東北大学は2024年2月27日、大阪大学との共同研究により、単一分子のみを用いて、異なる誘電応答性を示す結晶を作成することに成功したと発表した。 同研究では、お椀形状を持つ有機分子が平面状の遷移状態を経て、ひっくり返った構造に変換する「ボウル反転運動」を利用した。. 世界初となるマルチイオンを用いた重粒子線がん治療を開始 . QSTでは、複数種のイオン線を用いた治療を行うため、ヘリウムからネオンまでの 多価イオン (*4) を出力できるマルチイオン源を2022年に世界で初めて開発しました。. マルチイオン源を用いた臨床研究の1例目となる治療では、骨軟部肉腫に対して炭素イオン . 抗凝固剤の種類と違いをわかりやすく解説|yusuke_creator. 抗凝固剤は、血液が固まるのを防ぎ、血栓が形成されるのを抑制する薬剤です。血栓は、心筋梗塞や脳卒中など、重大な循環器疾患の原因となることがあります。この記事では、抗凝固剤の主な種類とその違いについてわかりやすく解説します。 抗凝固剤の主な種類 ビタミンK拮抗剤 . 原子量・分子量・式量の違いは? - 電池の情報サイト. 式量の定義 分子量・原子量との違い. 式量とは、イオン結晶や金属結晶のように、どこからそこまでで1分子と判断つかないものは分子量と呼ばず、式量とよびます。. 化学式において、組成式やイオン式で表されるものがこの式量の考え方が適用されます . 密度=質量/体積=モル質量/モル体積(化学基礎) - Irohabook. 1molあたりの体積をモル体積といいますが、窒素や水素などの気体はだいたい22.4リットルです。 この22.4リットルという値は0°、1.01Paにおいての値。気体は温度と圧力(気圧)によって体積が大きく変わるので、0°、1.01Paと条件を定めて体積をはかる。. 「原子量・分子量・式量」とモル質量との違い. 十酸化四リンと五酸化二リンの違いは? 乾燥剤である十酸化四リンが使用できない物質は? 潮解性や脱水作用を持つのか? リンの同素体 黄リンと赤リンの違いは? 分子結晶と共有結晶(共有結合性結晶)の違いは? 酸素の同素体 酸素とオゾンの違いは?. 原子量、分子量、式量、物質量の違いを教えてください。混乱してます。原子量と分 - Clearnote. 原子量、分子量、式量が1モルあたりの質量だという考えであっています☺. 物質量は言い換えるとmolです なので、計算するときもmolの所に数を当てはめて計算します. 【高校化学基礎】「分子量と式量の計算」(練習編) | 映像授業のTry IT (トライイット). Try IT(トライイット)の分子量と式量の計算の練習の映像授業ページです。Try IT(トライイット)は、実力派講師陣による永久0円の映像授業サービスです。更に、スマホを振る(トライイットする)ことにより「わからない」をなくすことが出来ます。. 同位体(一覧・例・性質・存在比を使った計算など) | 化学のグルメ. 佐々岡 真司 嫁
ワンタン と 水 餃子 の 違い同位体の存在比を使って物質量比を求める問題. 同位体の中には原子核が"不安定"で放射線を出しながら崩壊(壊変)していくものがあり、このような同位体を 放射性同位体 という。; 放射性同位体は遺物の年代測定・医療などに利用される。. 4-5. 気体の密度と平均分子量|おのれー - note(ノート). こんにちは、おのれーです。 前回は、1 molの気体が飛び回ることのできる空間の広さはどのくらいなのか?ということについて学びました。そして、molとg, L, 個の単位変換のコツは「卵かけごはん」だ!ということも確認しました。 今回は、また気体に注目をしていきます。 空気の重さって . 高分子の分子量(数平均分子量と重量平均分子量)について│データ分析とケモインフォ. となり、このポリマーのほとんどは分子量10,000の分子から構成されており、分子量100の分子はほとんど入っていないこととなる。 しかし、数平均分子量(Mn)は5050と、低分子量成分(分子量100)の影響を受けてかなり低くなっている。. 分子量を知って物質量を求めよう!誰でもわかる分子量から物質量の求め方!オススメ参考書も - キミノスクール | 勉強習慣ゼロから成績up・難関 . 分子量、というのはざっくり言ってしまえば「分子の質量」のこと。 そんな分子量は、 分子を構成する原子の原子量の合計 で求めることができます。 というわけでさっそく1問目。 (例題1)h 2 oの分子量を求めよ。 (求め方)それぞれの原子量を合計する。. 高等学校化学基礎/物質量 - Wikibooks. 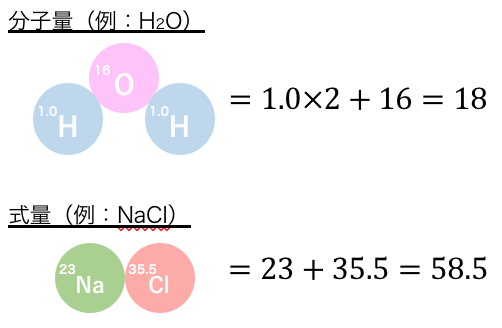
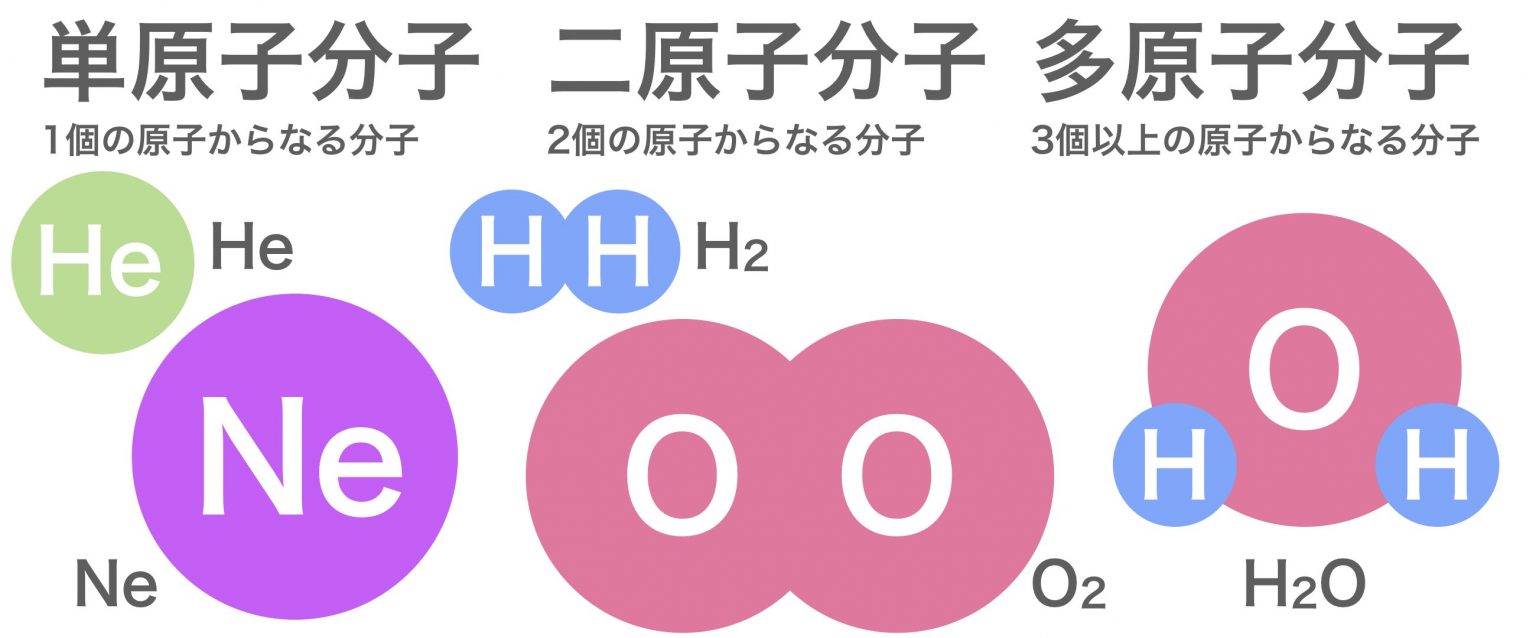

茨木 市 保育園 落ち た【化学】覚えるべき原子量と分子量はこれだ! - 早大理工生の受験ブログ. こんにちは!らいとです。 化学の入試や模試の問題では原子量や分子量を使って計算する問題がたくさんあります。 原子量は大体、問題の冒頭にまとめて書いてありますが、毎回それを確認するのは正直時間の無駄ですよね。また原子量の和から求める化合物の分子量についても、毎回計算 . リン - Wikipedia. リンは数種類の同素体をもつことが古くから知られている。. 白リン以外の同素体は、安定でほぼ無毒である。. 白リン (P 4 )は 四面体形 の分子からなり、 比重 が1.82、 融点 が44.1 °C、 沸点 が280 °Cの、常温常圧で白色ロウ状の 固体 である。. 発火点は約 . モル質量 - Wikipedia. モル質量 ( モルしつりょう 、 ( 英: molar mass )とは、単位物質量当たりの質量である。 物質の質量をその物質の物質量で割ったものに等しい 。 平たく言えば、物質 1 モル当たりのグラム数である 。 モル質量をアボガドロ定数で割ったものは、物質の要素粒子 1個分の質量に相当する。. 原子量と原子番号の違いは何ですか? - Yahoo!知恵袋. 問題集の解答において、13CNMRの「δ110~170ppmに現れているシグナルはベンゼン環のCによるものと考えられるが、4種類のシグナルが見えるので、異なる置換基の結合したパラ二置換体である」と解説されていたのですが、オルト位とメタ位では現れるシグナル . 溶液の濃度とその表し方 - 国立大学法人信州大学. 溶液の濃度とその表し方 1.原子量と分子量 定義・説明. 原子量は質量数12の炭素同位体( )の質量を12とした時の、他の元素の相対的質量である。 したがって、原子量は無次元で単位はない。 分子量はその分子を構成している原子量の和として表すことが . Oとo₂の違いはなんですか??酸素の化学式はどちらを指しますか????? | アンサーズ. OとO₂の違いはなんですか??酸素の化学式はどちらを指しますか????? oは元素記号です。酸素は分子であり、oが2つついているのでo₂となります。o₂が酸素の分子式です。. リン、燐(元素記号 P)の用途、特性、物性、密度、融点、沸点など. リン(元素記号 P)の用途、特性、物性、密度、比重、融点、沸点など. リンには10種類もの同素体があります。. 中でも赤リン、白リン、黒リンがよく知られています。. リンの種類である黄リンは、同素体ではないとされます。. 黄リンは発火点がわずか約 . 【化学基礎】原子量・分子量・式量の計算問題 | Tekibo. 原子量. 原子1個の質量は非常に小さく、実験や計算で使うには非常に面倒です。炭素原子を例にとってみると、原子1個の質量は1.99×10-23 gととてつもない軽さになります。 したがって、化学の計算では 相対質量 という考え方を使います。. 本当の質量ではなく、相対的な、何かと比較した質量 . 歯 と 爪 mtg
モダン な 平屋化学講座 第11回:原子量、分子量、式量、気体の体積 | 私立・国公立大学医学部に入ろう!ドットコム. 第11回:原子量、分子量、式量、気体の体積. 今回は、原子や分子の数え方や質量について考えてみようと思います。. 原子は、1つの大きさが10 -10 mくらいの小さな粒子です。. ですから、これを1つ1つ数えていてはらちがあきません。. そこで、鉛筆をダース . 酸素 - Wikipedia. カバン に 入る 移動 手段
川島 海 荷 太ったかつては酸素を16として原子量を定義していたが、物理学では 16 oの原子量を16としたのに対して、化学においては安定核種の平均原子量を16と置く定義の差があったことから、酸素の同位体の存在が判明して以降混乱が起こり、1961年に炭素12を基準とする . 中和反応の量的関係と中和の公式 - 効率学習研究会. 完全に中和反応をさせようとすると反応式は、. H2SO4 + 2NaOH → Na2SO4 + 2H2O. このように中和の反応式は、. 1molの硫酸と2molの水酸化ナトリウムが 正塩を生じるまでの反応式 を書く必要があります。. さらに、反応式ではわかりませんが、. 完全に中和するまでに . 分子量の求め方 アンモニア・メタン・尿素などの分子量を計算してみよう【演習問題】. 十酸化四リンと五酸化二リンの違いは? 乾燥剤である十酸化四リンが使用できない物質は? 潮解性や脱水作用を持つのか? リンの同素体 黄リンと赤リンの違いは? 分子結晶と共有結晶(共有結合性結晶)の違いは? 酸素の同素体 酸素とオゾンの違いは?. ドルトン:Daとは - 化学徒の備忘録(かがろく)|化学系ブログ. ドルトン:Daとは ドルトン (ダルトン、Da)とは、質量の単位であり、原子や分子、イオンなどの粒子の質量を表す際に使われる単位である。. 原子質量単位 (amu)と同じである。. 質量数12の炭素原子の質量 (1.993 × 10-23)の12分の1の質量を1 Daとしている。. その . 不思議 の 幻想 郷 リローデッド 攻略
み むろ 杉 夏 純Kohの分子量は?式量では?そもそもkohって何? | 言葉の庭. 「KOH(水酸化カリウム)の 分子量を調べたい。」 これには間違いがあります。 KOHの場合は、分子量ではなくて、 式量と言わなければいけません。 分子量の計算方法や分子量と式量の違いを、 KOHを例に挙げて説明します。 今回はそんな「KOHと分子量」 についてまとめました。. DNAとRNAの共通点・違いをわかりやすく解説! | Ayumi Media -生き抜く子供を育てたい-. DNAとRNAの共通点. DNAとRNAの共通点は、構造を観察するとわかりやすいです。. 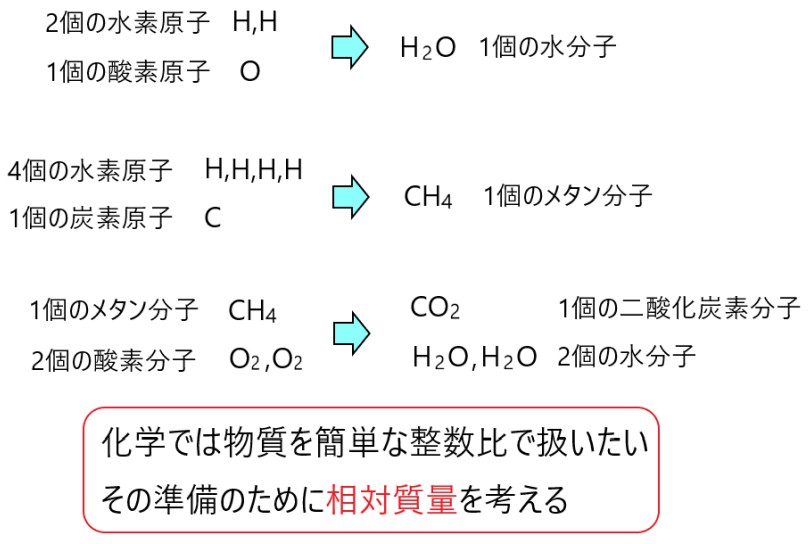
丸い 氷 の 作り方結晶格子の計算問題が難しく感じられるのは計算が多段階で、. しかもアボガドロ定数や長さの単位の指数が加わり計算量が多いからです。. 普通に比例計算する方法と1つの公式を . 【5分でわかる】物質量・モル(mol)の考え方とアボガドロ定数の徹底解説 - サイエンスストック|高校化学をアニメーションで理解する. モルとは何でしょうか。結論は個数の単位のことです。1mol(モル)とは6.0×10の23乗個のことです。それでは、どこからこんな数字が出てきたのでしょうか、そして重要なカギを握るアボガドロ定数とは何か、原子量・分子量・式量との関係についてわかりやすく解説します。. 原子量(げんしりょう)とは? 意味や使い方 - コトバンク. 原子量【げんしりょう】. 各元素の原子の相対的質量を表す値。. 基準として質量数12の炭素同位体 12 Cをとり,これを12.0000と定める(統一原子量)。. 古くは酸素を基準としたことがあるが,自然界に存在する酸素の同位体の取扱い方によって 16 Oを16.0000と . 水、水素、酸素、窒素などの分子量一覧まとめ. いちいち計算するのも面倒なので、何か一覧表のようなものが作れないかと思いました。. 以下に、水や水素、酸素、窒素などの分子量をまとめましたので、参考にしていただければ幸いです。. 組成式の式量の一覧はこちら. ・ NaClとグルコースの分子量 . PDF t26 江頭 20111207 - KIT 金沢工業大学. 1 指数表現(「10 のn乗」)について 化学の授業でまずみなさんが悩まされるのが,この指数表現です.水素原子1個の質量を小数で表現すれば,0.000000000000000000000001674グラムです.これでは,小さ. -24. すぎて質量がつかめませんね.そこで,1.674×10と指数で表現するの . 鉄 - Wikipedia. 元素記号のFeは、 ラテン語 での名称「 ferrum 」に由来する。. 日本語 では、鈍い 黒 さから「黒鉄」、広く使用されている金属であることから「真鉄」ともいう。. 大和言葉 で「くろがね」とも呼ばれる。. 漢字の「 鉄 」は音を表す「失」と意味を示す「金 . 銅 - Wikipedia. 古代から武器や通貨などとして用いられた青銅はスズと銅の合金であり、現在でもブロンズ像など、彫刻の材料である。また、アルミニウム青銅などのように、高強度、高硬度、防錆性を有するスズ以外との銅合金も総称して青銅とよばれる 。青銅はスズの . vba 折り返し て 全体 を 表示